جزوی دباؤ اور وانپر پریشر کے درمیان فرق
جزوی دباؤ اور وانپ دباؤ عام طور پر استعمال کیا جاتا ہے نظام اجزاء کی طرف سے زور دیا دباؤ کی مقدار سے متعلق سائنسی اصطلاحات، لیکن ان کی شناخت دوسروں کو الجھن کر سکتی ہے. ان کی شرائط اور شناخت سمیت ان شرائط کے درمیان واضح فرق ہے. یہ مضمون ان شرائط کے درمیان اختلافات پر مزید وضاحت کرے گا. اس میں کچھ مثالیں بھی شامل ہوں گے جو اس کے ایپلی کیشنز کو نمٹنے کے لۓ ہیں.
ہم دباؤ اور جزوی دباؤ کے درمیان فرق میں ڈیل کر سکتے ہیں سے پہلے دباؤ کے تصور کو اجاگر کرکے شروع کریں. دباؤ سائنسی طور پر بیان کیا جاتا ہے جس کے تحت کسی یونٹ یا مادہ پر فی یونٹ لاگو ہوتا ہے. یہ بھی ایک دوسرے پر ٹھوس ٹھوس کی طرف سے لاگو طاقت کے طور پر تعریف کیا جا سکتا ہے اور اکثر Pascal کا استعمال کرتے ہوئے ماپا جاتا ہے. ذرات کی تصادم کے معاملے میں، گیس کے مساوات اور گندم نظریاتی اصول دباؤ کا حساب کرنے کے لئے استعمال کیا جاتا ہے.
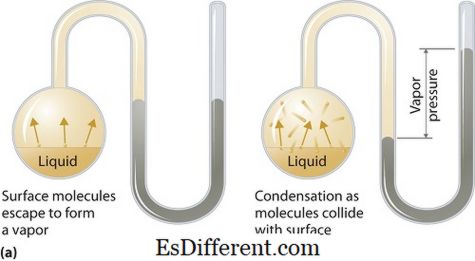
وانپ دباؤ کیا ہے؟
وانپ دباؤ مائع یا ٹھوس مراحل پر لاگو کرسکتے ہیں. یہ وپور کی طرف سے اس تھرڈڈیوڈینک مساوات میں اس کے مائع یا ٹھوس ریاست پر بند شدہ نظام میں ایک درجہ حرارت پر جب دباؤ اور مائع (ٹھوس) دونوں رابطے میں موجود ہیں تو یہ دباؤ ہے. یہ دباؤ vaporization کے نتیجے کے طور پر پیدا ہوتا ہے، جو ٹھوس یا مائع پر بڑھتی ہوئی گرمی کی طرف سے فعال ہے. اس طرح درجہ حرارت وانپورائزیشن کی پیمائش کے طور پر استعمال کیا جاتا ہے اور یہ ویر دباؤ کے براہ راست تناسب ہے. اس کا مطلب یہ ہے کہ، اعلی درجہ حرارت وپر دباؤ زیادہ ہے.
واپورائزیشن کے دوران، ہوا آلودگی ایک بند نظام میں ہوا کے لئے اعلی متحرک توانائی کے نتیجے کے طور پر فرار ہو. اس وقت جب مساوات میں، وانپ کے دباؤ میں ویر اور اس کے کنسرسی شکل مائع (ٹھوس) کے درمیان ہوتا ہے. حل میں جہاں انٹرومولک فورسز کمزور ہیں، واپر دباؤ زیادہ اور، اس کے ساتھ، اس بات کا حل ہے کہ ان مسائل میں جہاں اندرونی فورسز مضبوط ہوتے ہیں، واپر دباؤ کم ہے.
مثلا مرکب میں وپر دباؤ بھی ہوسکتا ہے جیسا کہ راولٹ کے قانون کی طرف سے وضاحت کی گئی تھی. یہ یہ بتاتا ہے کہ مائع یا ٹھوس مرکب میں کسی خاص جزو کے جزوی وانپ دباؤ کے برابر درجہ حرارت پر اس مرکب میں اس کے تل قطب کی طرف سے ضرب اس حصے کے وانپ دباؤ کے برابر ہے. مندرجہ ذیل مثال اس کی وضاحت کرے گا.
مثال 1.
0. مول کی مثالی مرکب کو دیا. ایتھنول اور 1. 5 mol. 30 کلومیٹر اور 52 کلومیٹر کے وانپ دباؤ کے ساتھ مییتانول، ہر اجزاء کے جزوی وانپ دباؤ کا تعین کرتے ہیں.
حل:
مولز کی کل تعداد 1.5mol + 0. 5mol = 2. 0mol. راولٹ کے قانون کے مطابق، جزوی وانپ کا دباؤ اس خاص جزو کے بطور حصے میں ضرب ہونے والے وپر دباؤ کے برابر ہے.اس صورت میں، پی میتانول = 1. 5/2 * 52 = 39 کلومیٹر اور پی ایتھنول = 0. 5/2 * 30 = 7. 5 کلو.
جب آپ کے مرکب میں اجزاء کے جزوی وانپ دباؤ ہوتے ہیں، تو آپ ان کے ساتھ مل کر بطور کل وانپ دباؤ حاصل کرسکتے ہیں. اس سلسلے میں، 7. 5 + 39 دیتا ہے 46. ایتھنول اور مییتانول کے حل کے مرکب کے 5KPa کل وانپ دباؤ.
ویکٹر دباؤ کو متاثر کرنے والے عوامل
انوٹ شناخت
جیسا کہ اوپر سے پہلے ذکر کیا گیا ہے، آلودگی فورسز کی قسموں سے نمٹنے کے لئے ویر دباؤ کی مقدار کا تعین ہوتا ہے. اگر فورسز مضبوط ہوتے ہیں تو پھر کم وانپ دباؤ سامنے آتی ہے، اور اگر کمزور ہو تو پھر زیادہ وانپ دباؤ بڑھ جاتی ہے. لہذا، مائع یا ٹھوس کی ساخت وانپ دباؤ کو متاثر کرے گا.
درجہ حرارت
اعلی درجہ حرارت زیادہ ویر دباؤ کی وجہ سے ہوتا ہے کیونکہ اس سے زیادہ متحرک قوتوں کو انوکی قوتوں کو توڑنے کے لئے متحرک ہوتا ہے تاکہ انوکوں کو تیزی سے مائع کی سطح سے بچ سکیں. جب وانپ دباؤ (سنترپت وانپ دباؤ) بیرونی دباؤ کے برابر ہوتا ہے (وایمپرمشرک دباؤ) مائع ابلاغ شروع ہوجائے گا. کم درجہ حرارت کم وپر دباؤ کے نتیجے میں ہوگا اور مائع کے لئے وقت لگے گا.

جزوی دباؤ کے ڈالٹن کا قانون
جزوی دباؤ کیا ہے؟
نامیاتی دباؤ کا خیال سب سے پہلے معروف سائنسدان جان ڈالٹن کی طرف سے پیش کیا گیا تھا. اس نے جزوی پریسس کے اپنے قانون کو جنم دیا جس میں کہا گیا ہے کہ گیسوں کے مثالی مرکب کی طرف سے پیش کردہ کل دباؤ انفرادی گیسوں کے جزوی دباؤ کے برابر ہے. ایک خاص کنٹینر سے کہا جائے کہ ہائڈروجن، نائٹروجن اور آکسیجن گیسوں سے بھرا ہوا ہے، کل دباؤ، P TOTAL، آکسیجن، نائٹروجن اور ہائڈروجن کے برابر ہو جائے گا. اس مرکب میں کسی بھی گیس کے جزوی دباؤ کو انفرادی گیس کے ملالہ حصے کی طرف سے کل دباؤ کو ضائع کرنے کی طرف سے شمار کیا جاتا ہے.
ایک مختصر میں، جزوی دباؤ میں ایک مخصوص گیس کی طرف سے مرکب میں دباؤ ڈال دیا جاتا ہے جیسا کہ اگر یہ نظام میں اکیلے کام کر رہا تھا. اس طرح آپ کسی دوسرے گیس کے جزوی دباؤ کا تعین کرتے وقت دوسرے گیسوں کو نظر انداز کرتے ہیں. یہ اصول انجیکشن کی طرف سے تصدیق کی جاسکتی ہے، کہہ دو، اے کے 9 6> 2 10 میں 0 ایک 0 کلو کنٹینر اور اس کے بعد انجیکنگ 0. 4 فیٹ ایم 2 ایک جیسی کنٹینر میں اسی درجہ کے اسی سائز میں، اور پھر آخر میں گیسوں کو مجموعی دباؤ کی پیمائش کے لئے یکجا؛ یہ دو گیسوں کی رقم ہوگی. یہ واضح طور پر غیر فعال ردعمل کے مرکب میں ایک انفرادی گیس کے جزوی دباؤ کی وضاحت کرتا ہے. جزوی دباؤ کا حساب لگانا
ڈیلٹن کے قانون کے بعد سے جزوی دباؤ کا حساب کرنے کے لئے ایک مکمل ہوا ہے. [1] اس کے لئے شرائط فراہم کرتی ہے. یہ فراہم کردہ عام معلومات پر منحصر ہے. اگر، مثال کے طور پر، گیس اے اور بی کے ساتھ ساتھ گیس اے کے دباؤ کے لئے کل دباؤ دیا جاتا ہے، بی کے جزوی دباؤ کو شمار
TOTAL = P کی طرف سے شمار کیا جاسکتا ہے. A + P B . باقی جغرافیائی ہتھیار ہے. لیکن ایک صورت میں جہاں مرکب کا صرف کل دباؤ دیا گیا ہے، آپ جزوی دباؤ کا تعین کرنے کے لئے گیس بی کے ملالہ حصے کا استعمال کرسکتے ہیں.X کی طرف سے مسترد ملال کا حصہ، گیس بی کے ملوں کو گیس کے مرکب کے مجموعی میووں کے ذریعے تقسیم کیا جاسکتا ہے. اس کے بعد جزوی دباؤ کو تلاش کرنے کے لئے، آپ کل دباؤ کے ذریعے ملال کا حصہ، ایکس ضائع کریں گے. ذیل میں مثال بیان کرتا ہے کہ. مثال 2. 2. نالروجن اور آکسیجن کا مرکب، 2. 2. 5 moles اور 1.85 moles کے ساتھ، क्रमशः 20. 0L کنٹینر میں 4 انجکشن کے مکمل دباؤ کے ساتھ انجکشن ہے؛ آکسیجن گیس کی طرف سے پیش کردہ جزوی دباؤ کا حساب لگائیں.
حل:
مرکب میں moles کی کل تعداد 2. 5 + 1. 85 = 4. 35 moles. لہذا آکسیجن، ایکس
او
کے بائنل حصہ، 1. 85 moles / 4 ہو. 35 moles = 0. 425 moles. آکسیجن کا جزوی دباؤ 0 425 * 4 فیٹ = 1. 7 میٹر ہو گا. باقی گیس کے جزوی دباؤ کو اسی نقطہ نظر کے مطابق شمار کیا جاسکتا ہے یا آکسیجن گیس اور کل دباؤ کا استعمال کرتے ہوئے کی جا سکتی ہے جیسا کہ ڈالٹن کے جزوی قانون کے جزوی دباؤ کی وضاحت کرتا ہے کہ غیر رد عمل گیسوں کا کل دباؤ برابر ہے. جزوی دباؤ. وانپ اور جزوی دباؤ کے درمیان فرق اس سے وضاحت کی وضاحت سے، یہ واضح ہے کہ وانپ دباؤ اور جزوی دباؤ دو مختلف دباؤ ہیں. واپر دباؤ مائع اور ٹھوس مرحلے پر لاگو ہوتا ہے جبکہ جزوی دباؤ گیسس مرحلے پر ہوتا ہے. مرحلے کی منتقلی میں ویر دباؤ کا اظہار کیا جاتا ہے کے بعد کافی گرمی کو حل میں شامل کیا گیا ہے لہذا اس طرح ایک بند نظام میں فرار ہونے کے لئے اس کے انو انو کی طرف بڑھتی ہوئی ہے.
جزوی دباؤ اور وانپر دباؤ کے درمیان اہم فرق یہ ہے کہ جزوی دباؤ ایک انفرادی گیس کے ذریعہ ایک مرکب میں پیش کیا جاتا ہے جیسا کہ اگر اس نظام میں اکیلے تھے تو، ویر دباؤ نے وانپر کی طرف سے زور دیا دباؤ سے مراد ترمیم کی حالت مائع یا ٹھوس کے ساتھ ترمیم. مندرجہ ذیل کی میز ان پریشانوں کا ایک جامع مقابلے فراہم کرتا ہے.
وانپر پریشر
جزوی دباؤ
| اس سے مسابقتی گیس پر مائع یا ٹھوس وانپ کی طرف سے پیش کیا جاتا ہے | یہ غیر غیر فعال طور پر گیس مرکب میں انفرادی گیسوں سے نمٹا جاتا ہے |
| ٹھیک ہے راؤلٹ کی طرف سے وضاحت کی. قانون | ٹھیک ہے دالٹن کے قانون کی طرف سے وضاحت کی ہے |
| ٹھوس اور مائع مراحل میں قابل اطلاق | گیس مرحلے میں قابل اطلاق صرف |
| سطح کے علاقے سے آزاد یا نظام کی حجم | اسی میں گیسوں کا استعمال کرتے ہوئے حجم |
| سوراخ | گیس کے تل حصوں کا استعمال کرتے ہوئے حساب کی سوراخ کے حصول کے حساب سے شمار کیا |
| لپیٹ! | وانپر دباؤ اور جزوی دباؤ دو اہم سائنسی اصطلاحات ہیں جو خاص طور پر درجہ حرارت پر دی گئی بند نظام میں، بالترتیب بال و گیسوں کی طرف سے لاگو فورسز کے اثرات کا تعین کرنے میں استعمال ہوتے ہیں. ان کا اہم فرق درخواست والے علاقے ہے جس کے ساتھ ویر دباؤ کے ساتھ مائع یا ٹھوس مرحلے پر لاگو ہوتا ہے، جبکہ جزوی دباؤ کسی مخصوص مقدار میں مثالی گیسوں کے ایک مرکب میں استعمال ہوتا ہے. |
جزوی دباؤ کا جزوی جزوی قوانین کے دلال پر عمل کرتے ہوئے آسانی سے شمار کیا جاتا ہے، جبکہ راول کے قانون کو لاگو کرکے واپر دباؤ کا حساب کیا جاتا ہے.کسی بھی مرکب میں، ہر گیس کے اجزاء کو اپنے دباؤ کو فروغ دیتا ہے، جس کو دوسرے گیسوں سے آزاد ہونے والی جزوی دباؤ کہا جاتا ہے. اور جب آپ مسلسل باقی درجہ حرارت کے ساتھ کسی بھی جزو کے موال کو دوگنا کرتے ہیں، تو آپ اس کے جزوی دباؤ میں اضافہ کریں گے. Clausius-Clapeyron رشتہ کے مطابق [2]، درجہ حرارت میں اضافہ کے طور پر وانپ دباؤ میں اضافہ.
واضح طور پر معلومات کے ساتھ، آپ کو ویر دباؤ اور جزوی دباؤ کے درمیان فرق کرنے کے قابل ہونا چاہئے. آپ کو مجموعی دباؤ کے ذریعے ملالہ کے اجزاء کا استعمال کرتے ہوئے ان کو شمار کرنے کے قابل بھی ہونا چاہئے. ہم نے آپ کو عام مثالیں دی ہیں تاکہ ان دباؤوں کی درخواست پر وضاحت کریں.


