فیرس گلیوونیٹ اور فیرس سلفیٹ کے درمیان فرق
فیرس گلیوونیٹ بمقابلہ فیرس سلفیٹ
آئرن ایف کے ساتھ ڈی بلاک میں دھات ہے. یہ زمین کا سب سے عام عناصر میں سے ایک ہے اور زمین کی اندرونی اور بیرونی کور میں بڑی مقدار ہے. یہ زمین کی کیڑے میں چوتھا سب سے زیادہ عام عنصر ہے. لوہے سے آکسائڈریشن -2 سے +8 تک ہے. ان +2 اور +3 فارم میں سب سے زیادہ عام ہیں. +2 لوہے کی آکسائڈریشن فارم فیرس کے طور پر جانا جاتا ہے اور +3 فارم ferric کے طور پر جانا جاتا ہے. یہ آئنوں آئنک کرسٹل کی شکل میں ہیں، جو مختلف آئنوں کے ساتھ بنائے جاتے ہیں. مختلف مقاصد کے لئے حیاتیاتی نظام کے لئے لوہے کی ضرورت ہوتی ہے. مثال کے طور پر انسانوں میں، فیرس ہیموگلوبن میں chelating ایجنٹ کے طور پر پایا جاتا ہے. یہ پودوں میں کلورفیل کی ترکیب کے لئے بھی ضروری ہے. لہذا، جب اس آئن کی کمی ہے، حیاتیاتی نظام مختلف بیماریوں کو ظاہر کرتی ہیں. فیرس gluconate اور فیرس سلفیٹ دو آئنک مرکبات ہیں جو زندہ نظام میں لوہے کے عدم استحکام پر قابو پانے کے لئے فیرس سپلیمنٹس کے طور پر دی جاسکتی ہیں.
فیرس گلکوونیٹ
گلوکوک ایسڈ کی لوہے کی نمائش میں سے ایک فیرس گلوکوز کے طور پر جانا جاتا ہے. گلوکوک ایسڈ کی کار باکسائلک ایسڈ گروپ اس نمک کو پیدا کرنے کے لئے فیرس کے ساتھ رد عمل کرتا ہے. اس نمک کی پیداوار کرتے وقت دو گلوکوز آئنوں کو فیرس آئن سے منسلک کر رہے ہیں. اس میں سی 12 ایچ 24 فیو 14 کے آلوکولر فارمولہ ہے. کمپاؤنڈ کے مولول بڑے پیمانے پر 448 ہے. 15. فیرس gluconate مندرجہ ذیل ساختہ ہے.
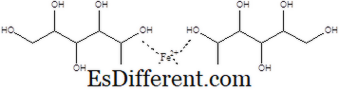
یہ ایک ٹھوس ہے، جس میں بھوری / سیاہ ظہور اور ہلکا سا کیرمیل گند سے ہلکی پیلا ہے. فیرس gluconate پانی میں گھلنشیل ہے. یہ جسم کے لئے لوہا ضمیمہ کے طور پر استعمال کیا جاتا ہے. مارکیٹ میں، فیرس گلوکوانیٹ برانڈ ناموں کی طرح فرگون ، فریالیٹ ، اور سمون کے تحت فروخت کیا جاتا ہے. ہائکوکرمک انیمیا جیسے بیماریوں کے باعث، جو جسم میں لوہے کی کمی کی وجہ سے ہوتی ہے، فیرس گلوکوان کو دیا جاتا ہے. اس کے علاوہ، فیرس gluconate ایک کھانے کی اضافی کے طور پر استعمال کیا جاتا ہے.
فیرس سلفیٹ
فیرس سلفیٹ کیمیکل فارمولہ فیسو 4 کے ساتھ ایک آئنک مرکب ہے. یہ مختلف کرسٹل اقسام میں موجود ہوسکتا ہے جو پانی کے انووں سے منسلک ہوتا ہے. اس میں ایک ہڈی فارم، مونہایڈریٹ، tetrahydrate، pentahydrate، hexahydrate اور ہایپٹہائیڈریٹ فارم ہے. ان میں سے، نیلا، سبز رنگ ہیپتہائیڈیٹ فارم عام ہے. Monohydrate، pentahydrate اور ہیکسہائیڈریٹ فارم نسبتا نایاب ہیں. نیلے، سبز رنگ کے کرسٹل کے علاوہ، فیرس سلفیٹ کے دیگر شکلوں میں زیادہ تر سفید رنگ کے کرسٹل ہیں. جب ہائیڈریٹڈ کرسٹل ڈھیلے پانی کو گرم کرتے ہیں اور ایک ہائیڈرالک ٹھوس بن جاتے ہیں. مزید حرارتی طور پر، یہ سلفر ڈائی آکسائڈ، سلفر ٹرا آکسائڈ اور آئرن (III) آکسائڈ (لال رنگ بھوری رنگ) میں خراب ہوتا ہے.وہ بے چینی کرسٹل ہیں. فیرس سلفیٹ آسانی سے پانی میں منحصر ہے اور، اس صورت میں، فیرس آئن ہیسا اکا پیچیدہ ہے، [فی (ایچ 2 او) 6 ] 2 + . فیرس سلفیٹ آئرن کی کمیوں جیسے لوہے کی کمی انمیا کی حالتوں کا علاج کرنے کے لئے استعمال کیا جاتا ہے. نہ صرف انسانوں کے لئے، یہ بھی پودوں میں بھی شامل ہے. لوہے کلوروسیسی جیسے حالات میں، جہاں پودے کی پتی زرد ہو جاتی ہے، پیلا رنگ فیرس دی جاتی ہے. اس کے علاوہ، یہ دوسرے مرکبات کو سنبھالنے کے لئے ایک ابتدائی طور پر استعمال کیا جاتا ہے. چونکہ یہ کمیٹی کا ایجنٹ ہے، اس کے ساتھ ساتھ ریڈکس ردعمل کے ساتھ بھی استعمال ہوتا ہے.


