متونومک اور ڈائاتومک کے درمیان فرق | مونیٹومک بمقابلہ Diatomic
مونیٹومک اور ڈائٹومک کے درمیان فرق بنیادی طور پر پرجاتیوں میں موجود جوہری طور پر ہے. جیسا کہ ناموں کا اشارہ ہے، دونوں اصطلاحات کو مختلف ممالک کے جوہری ایسوسی ایشنز کے لئے کھڑے ہیں جہاں 'مونو' کا مطلب ہے 'ایک' اور 'دی' کا مطلب ہے. 'لہذا، صرف، منیٹومک معنی ایک'
ایک ایٹم 'اور ڈائٹومک معنی' دو ایٹم ہیں. ' تاہم، اس بنیادی تعریف میں بہت سی مختلف حالتیں ہوسکتی ہیں. Monatomic کیا ہے؟
کبایک ہی ایٹم موجود ہے
(جس میں شاذ و نادر معاملہ ہے)، ہم اسے منیٹومک کہتے ہیں. اس کا مطلب ہے کہ عناصر ان کے خالص واحد شکل میں ہیں. اس قسم کے صرف ایک عملی مثال جو اس قسم کے تحت آسکتے ہیں وہ عظیم گیس ہیں جو اپنے آپ پر جوہری طور پر موجود ہوتے ہیں کیونکہ وہ اپنے بیرونی شیل کو برقیوں کے آکٹیٹ کے ساتھ مکمل کرتے ہیں. لہذا، وہ زیادہ مستحکم ہونے کے لئے کسی اور الیکٹران کو قبول یا عطیہ نہیں لگتے. لہذا، عظیم گیس معدنیاتی شکل میں مستحکم ہیں. کچھ مثالیں ہیں وہ - ہیلیم، نی نیون، ار ارجنون، جی - زینون، کر - کرریپٹن، آر این - رڈن.
ہیلیم
Diatomic کیا ہے؟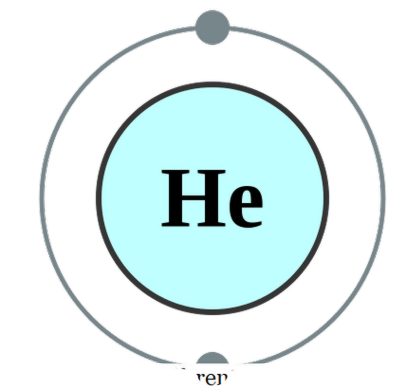
جب
دو جوہری ایک دوسرے کے ساتھ مل کر ہیں ، ہم اسے ڈائاتومک کہتے ہیں. یہ جوہری اسی قسم یا مختلف سے ہوسکتا ہے. جب ہم ایسوسی ایشن میں دو ملتے جلتے جوہری ہیں تو ہم اسے
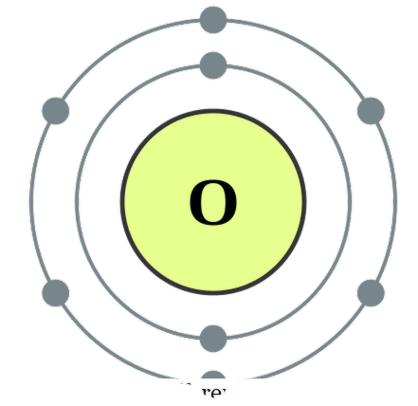
ہتھیاروں سے متعلق diatoms 'کہتے ہیں اور اگر وہ مختلف اقسام سے بنا رہے ہیں تو ہم اسے' ہیتروونیٹیکل ڈائاتوم 'کہتے ہیں. کچھ ہتھیاروں سے متعلق diatoms کے لئے مثال O2، N2، H2، وغیرہ ہو گی جبکہ CO، NO، HCl وغیرہ وغیرہ ہیٹرونٹولیٹری diatoms کے لئے مثال کے طور پر دی جا سکتی ہیں. آکسیجن Diatoms مرکبات کے طور پر سمجھا جا سکتا ہے کیونکہ وہ ان ایسوسی ایشنز کو ایک دوسرے کے ساتھ برقیوں کو شریک کرکے زیادہ استحکام حاصل کرنے کے لئے تشکیل دیتے ہیں تاکہ دونوں جوہری عظیم گیس الیکٹرانک ترتیب حاصل کریں. وہ جوہری بلبلوں کے اوپریپپیٹ کے ذریعے نوواں بینڈ کے ذریعے بانڈ کرسکتے ہیں یا پھر وہ ان کے درمیان آئنک بانڈ تشکیل دے سکتے ہیں جو مثبت طور پر چارج شدہ پرجاتیوں اور منفی چارجز پرجاتیوں کے درمیان ایک جذبہ قوت ہے. diatoms کے درمیان covalent بانڈز کے لئے مثالیں CO، NO، وغیرہ شامل ہیں اور HCl آئنک جذبہ کردار کے ساتھ ایک پرجاتی کے طور پر سمجھا جا سکتا ہے. تاہم، جیسا کہ H + اور CL کے درمیان جذبہ قوت بہت مضبوط نہیں ہے، یہ آئنک بانڈ کے لئے ایک بہت اچھا مثال نہیں ہے جو ایک اور وضاحت شدہ موضوع ہے. مونیٹومک اور Diatomic کے درمیان کیا فرق ہے؟ • مونیٹومک پرجاتیوں کو ایک ایٹم ہے جبکہ ڈائطومک پرجاتیوں کو دو جوہری ہے.
• مونیٹومک پرجاتیوں عام طور پر مستحکم نہیں ہیں، لیکن ڈائطومک پرجاتیوں عام طور پر مستحکم ہیں.
نوبل گیس صرف منیٹومک ہیں اور ڈائٹومک شکل میں نہیں ملتی ہیں.
کیمیاڈ بانڈز ڈائاتومک پرجاتیوں کے درمیان موجود ہیں جبکہ منیٹومک پرجاتیوں میں کوئی پابندی نہیں ہے.
تصاویر کورٹ:
پلما کی طرف سے ہیلیم الیکٹرون کی ترتیب (CC BY-SA 2. 0 یوآن)
ڈیپئیپ کی طرف سے آکسیجن الیکٹرون کی ترتیب (CC BY-SA 3. 0)




