اکٹیٹ اور ڈپلیٹ کے درمیان فرق | آکٹیٹ بمقابلہ ڈپلیٹ
کلیدی فرق - آکٹیٹ بمقابلہ ڈپلیٹ
فطرت میں موجود کیمیاوی فعال اور غیر فعال ایٹم یا مرکبات موجود ہیں. یہ خاص طور پر جوہری طور پر ایٹم کے سب سے بڑے گولوں میں موجود الیکٹرانوں کی تعداد پر منحصر ہے. جوہری طور پر ناقابل شکست گولیاں فعال ہوسکتی ہیں تاکہ ان کے برقی ترتیب کو مستحکم بن سکے. غیر فعال ہیں جو جوہری ایک مکمل الیکٹران کی ترتیب ہے؛ اس طرح، یہ ایٹم کسی دوسرے ایٹم کے ساتھ رد عمل نہیں کرتے جب تک کہ وہ خاص حالات نہ کریں. نوبل گیس ہمیشہ فطرت میں غیر فعال ہیں. اس وجہ سے، وہ اندرونی گیس کے طور پر جانا جاتا ہے. انٹری گیس دور دراز ٹیبل میں آٹھویں کالم میں ہیں. اسی مدت کے دیگر عناصر (قطار) اس مدت کے اختتام میں انتباہ گیس کے الیکٹرانشن کی ترتیب کو حاصل کرتے ہیں، جو فطرت میں سب سے زیادہ مستحکم شکل ہے. فعال آٹومس اوکٹیٹ کے اصول یا ڈپلیٹ کے اصول کے مطابق الیکٹرانکس کی تعداد کو مکمل کرنے کے لئے ہوتے ہیں. اوکٹیٹ اور دوپلیٹ کے درمیان اہم فرق یہ ہے کہ بیرونی آٹومیٹل شیل میں زیادہ سے زیادہ آٹھ الیکٹرانس آٹٹ یا آئن ہے، جبکہ دوپلیٹ ایک ایٹم ہے جس میں زیادہ سے زیادہ دو برقی بیرونی وسط میں ہے..
فہرست1. جائزہ اور کلیدی فرق
2. اکتوبر 3 کیا ہے. ایک ڈپلیٹ
4 کیا ہے. سائیڈ موازنہ کی طرف سے - آکٹیٹ بمقابلہ Duplet
5. خلاصہ
آکٹیٹ کیا ہے؟
ایک آکٹٹ ایک ایٹم یا آئن ہے جس میں آٹھ برقی بیرونی شیل میں آٹھ برقی ہوتے ہیں. ہیلیم کے علاوہ تمام عظیم گیسیں آٹھ برقی ہیں اور فطری طور پر معلول ہیں. ایک عظیم گیس کے الیکٹرانکس کی ترتیب ہمیشہ ہی ختم ہو جائے گی.
مثال کے طور پر، نیون کے الیکٹرانکس ترتیب 1s
2
2s2 - 2 -> ایس ایس 2
این پی 6 2p 6 . نیین ایک غیر معمولی گیس ہے. بیرونی عناصر میں 7، چھ، وغیرہ وغیرہ ہیں جن کے پاس الیکٹرانک حاصل کرنے کے ذریعہ بیرونی بیرونی آبائیوں میں برقی ہوتے ہیں. کچھ دوسرے عناصر ایک، دو، وغیرہ ہوتے ہیں، الیکٹرانز الیکٹرانوں سے محروم ہوتے ہیں اور قریبی ناکارہ گیس کے الیکٹران کی ترتیب کو حاصل کرتے ہیں. لیکن دور دراز ٹیبل کے وسط میں دیگر عناصر ان برقیوں کو شریک کرنے اور ایک آکٹیٹ بننے کے لئے زیادہ برقیوں کے عناصر کے ساتھ نئے پابند بنائے جائیں گے.
شناخت 01: نیون، ایک اوکٹیٹ
ایک ڈوپلیٹ کیا ہے؟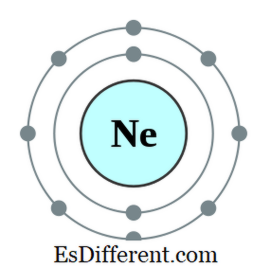
ہائڈروجن ایٹم اور ہیلیم ایٹم فطرت میں سب سے چھوٹی عناصر ہیں اور ان کے نچوضوں کے ارد گرد صرف ایک آبادی ہے. یہ آبادی 1s orbital کہا جاتا ہے. یہ آبادی میں زیادہ سے زیادہ دو برقی مشتمل ہوسکتا ہے. ہائیڈروجن ایٹم میں ایک الیکٹران اور ہیلیم ہے جس میں دو الیکٹران ہیں. لہذا، ہیلیومین کو دوپلی کہتے ہیں.ہیلیم میں زیادہ سے زیادہ الیکٹرانز ہیں جو اس میں ہو سکتے ہیں؛ اس طرح یہ فطرت میں مستحکم عنصر ہے. لہذا، ہیلیم بھی غیر فعال گیس ہے. لیکن ہائڈروجن میں صرف ایک الیکٹران ہے اور صرف ایک ہی آبادی یہ نامکمل ہے. اس طرح، صرف ہائڈروجن ایٹم بہت فعال ہے اور یہ صرف ان برقیوں کا اشتراک کر کے دوسرے ہائڈروجن ایٹم کے ساتھ ایک متحرک بانڈ بنانا چاہتا ہے. اس کے بعد ان ہائڈروجن جوہری جاںگھیا بن جاتے ہیں کیونکہ ان کے پاس اب تک دو الیکٹرانوں کے بیرونی بیرونی مدارس ہیں. لیکن لتیم اپنے بیرونی آبادی سے الیکٹرانک کو ہٹانے کی طرف سے ایک دوپہر کے طور پر بھی سلوک کر سکتا ہے. لیتیمیم کے الیکٹرون کی ترتیب 1s
2
2s 1 ہے. 2s 1 الیکٹران کو ہٹانے سے، یہ ایک ڈوپلیٹ بن سکتا ہے. اس صورت میں، وہ، ایچ - اور لی + دوپلی ہیں جو مستحکم ڈوپلیٹز کے طور پر موجود ہیں. تمام ڈوپلیٹز کو مندرجہ ذیل طور پر الیکٹرانشن کی ترتیب ختم کرنا ہے. این ایس
2
شکل 02: ہیلیم، ایک دوپلی اکتوبر اور ڈوپلٹ کے درمیان کیا فرق ہے؟

- مت ماضی آرٹیکل مڈل ٹیبل سے پہلے>>
آکٹیٹ بمقابلہ ڈپلیٹ
آٹھ بجٹ بیرونی آلے میں آٹھ الیکٹران ہے.
دوپلیٹ میں بیرونی برتن میں دو الیکٹران ہیں. |
|
| عام الیکٹران ترتیب | اختتام کے آخر میں الیکٹرون کی ترتیب میں نوک |
| 2 | |
| این پی 6 نوکری ہے. دوپلیٹ کے اختتام پر نو ترتیب 2 | ترتیب ترتیب ہے. آبادیوں کی تعداد آکٹیٹ میں کم از کم دو آبادی ہوسکتے ہیں. |
| ایک دوپلیٹ صرف ایک زبانی ہے. | |
| آبیبلز کی قسم | ایک آکٹیٹ کے تمام قسم کے مباحثے جیسے S، P، D، F، وغیرہ ہوسکتے ہیں |
| دوپلیٹ کے پاس صرف زبانی ہے. | |
| خلاصہ - آکٹیٹ بمقابلہ ڈپلیٹ | تمام عناصر مستحکم ہو جاتے ہیں. لیکن نامکمل الیکٹرون ترتیب کے ساتھ، جوہری مستحکم نہیں ہوسکتا؛ اس طرح، وہ گولیاں حاصل کرنے، کھونے یا شریک کرنے کے ذریعے برقیوں کے ساتھ گولیاں بھرنے کے لئے بہت فعال ہیں. آٹومیٹس یا انوولک جو آکٹیٹ یا ڈپلیٹ کی حکمران کی اطاعت کرتے ہیں مستحکم ہیں. آکٹیٹ اور ڈپلیٹ کے درمیان اہم فرق یہ ہے کہ آکٹیٹ کے پاس بیرونی بیرونی آبادی میں آٹھ الیکٹران موجود ہیں جبکہ دوبل میں اس کے آبائی میں دو برقی ہیں. |
حوالہ جات:
1. نیما، پی.، 2011. ٹاپپریننگ. [آن لائن] دستیاب ہے: // www. سب سے اوپر کام / فورم / گھر کے کام-مدد -19 / کیا-آکٹیٹ-ڈپلیٹ-وولٹیج-اور-آئنز-کیمسٹری-ساختہ-کی-اےٹم-ایٹم-46317 / جواب [جواب 05 05 2017].
2. چانگ، آر، 2010. کیمسٹری. 10th ایڈ. نیویارک: میک گرا ہل.
3. انون. ، 2015. گریڈ اسٹیکر. [آن لائن] دستیاب ہے: // gradestack. کام / NTSE-مکمل کورس / کیمیائی-پابندی / کیمیائی-سرگرمی کی ایک / 19176-3853-37737-مطالعہ-وٹیو [دستیاب 05 05 2017].
تصویری عدالت:
1. "الیکٹران شیل 002 ہیلیم - پبلک لیگ" (گریگ رابسن کی اصل کام) کی طرف سے - الیکٹون شیل ڈایاگرام (اسی لیبل شدہ ورژن) (CC BY-SA 2. 0 یوکرائن) کینیڈا ویکیپیڈیا کے ذریعہ
2 کے ذریعہ. "برقی روبوسن کی طرف سے اصل کام" (CC BY-SA 2. 0 یوآن) کینیڈا



