متوازن توازن اور نیٹ ایون کے مساوات کے درمیان فرق
کلیدی فرق - متوازن انضمام بمقابلہ نی نیٹ اونی مساوات
تمام کیمیائی ردعمل ایک مساوات کے طور پر لکھا جا سکتا ہے. اس مساوات کے اجزاء میں ان کے جسمانی ریاستوں، رد عمل کی سمت اور ان کے جسمانی ریاستوں کے ساتھ رد عمل کی مصنوعات کو دکھانے کے لئے ایک تیر شامل ہیں. اگر کوئی خاص حالات استعمال ہوتے ہیں، تو وہ تیر پر مختصر طور پر لکھا جاتا ہے. اگر ردعمل مساوات میں ہے تو، دو آدھے تیر کو مخالف سمتوں میں استعمال کیا جاتا ہے. ایک کیمیائی مساوات دو طریقوں میں لکھا جا سکتا ہے: متوازن مساوات یا نیٹ آئنک مساوات کے طور پر. متوازن مساوات اور خالص آئنک مساوات کے درمیان اہم فرق یہ ہے کہ متوازن مساوات تمام نظاموں میں ایک دوسرے کے ساتھ رونما دکھائے جاتے ہیں جبکہ خالص آئنک مساوات صرف خالص ردعمل سے ظاہر ہوتا ہے جو اس خاص کی تکمیل کے بعد ہوتی ہے. ردعمل
فہرست
1. جائزہ اور کلیدی فرق
2. متوازن توازن کیا ہے
3. نیٹ ایونیکی مساوات کیا ہے
4. سائیڈ موازنہ کے ذریعہ - متوازن تنصیب بمقابلہ نیٹ آئنیک مساوات
5. خلاصہ
متوازن توازن کیا ہے؟
مخصوص نظام کے رویے کو سمجھنے میں کیمیکل ردعمل بہت اہم ہیں. ردعمل کے لئے صحیح مساوات لکھنے سے، کسی نظام میں مختلف پرجاتیوں کی تبدیلیوں کے بارے میں ایک خیال حاصل ہوسکتا ہے. سادہ ردعمل جیسے پانی میں NaCl کی تحلیل کے طور پر، مساوات اس ردعمل کی ممکنہ مصنوعات کی پیشکش کی طرف سے آسانی سے لکھا جا سکتا ہے. لیکن دوسرے پیچیدہ ردعمل کے لۓ، اس مخصوص نظام کی مصنوعات کو تلاش کرنے کے لئے مزید ٹیسٹ کئے جا سکتے ہیں. لیکن اکثر اوقات، تحریری مساوات غیر مسلط ہونے کا امکان ہے، جو اس نظام کے کیمیکل رویے کی وضاحت کرنا مشکل بناتا ہے. لہذا، غیر متوازن مساوات بھی متوازن ہونا چاہئے. متوازن مساوات اس نظام کے تمام رینٹل اور مصنوعات شامل ہیں. مساوات ایک مرکب کے طور پر رینٹل کمپاؤنڈ پر غور کر کے لکھا جاتا ہے. مثال کے طور پر، کیو اور پی بی این او 3 کے درمیان متوازن مساوات (اگر انہیں پانی میں ردعمل کیا گیا ہے) ہو گا؛

متوازن مساوات کی اہمیت یہ ہے کہ یہ رینٹینٹس کی مقدار کو ظاہر کرتی ہے جس میں نظام میں پرجاتیوں کے درمیان stoichiometric تعلقات کے بارے میں تفصیلات فراہم کرنا چاہئے. مندرجہ بالا مثال میں، PBNO 3 اور KI کے درمیان تناسب 1: 2 ہونا چاہئے جب ان اجزاء کو نظام میں شامل کریں.
نیٹ ایونیکی مساوات کیا ہے؟
خالص آئنک مساوات صرف اس مجموعی ردعمل سے ظاہر ہوتا ہے جو اس نظام میں ہوتی ہے. یہ آئنک پرجاتیوں اور تشکیل شدہ مصنوعات شامل ہیں. لیکن یہ ایک مخصوص نظام میں ہوا ہے کہ تمام رد عمل کی نشاندہی نہیں کرتا. مثال کے طور پر، اگر درمیانے درجے کے ذریعے پانی کا استعمال کرتے ہوئے دو انوولکوں کے درمیان ایک ردعمل موجود ہے تو، مرکب پانی میں پھیل چکے ہیں اور آئنوں میں الگ ہوتے ہیں. ان میں سے بعض آئن ردعمل میں ملوث ہوسکتے ہیں لیکن کچھ بھی نہیں ہوسکتا ہے. اس کے بعد خالص آئنک مساوات صرف آئنوں میں شامل ہیں جنہوں نے خالص رد عمل میں حصہ لیا. دوسرے آئنوں کو جو سپراٹر ایونز کہتے ہیں، انہیں خالص آئنک مساوات حاصل کرنے کے مساوات سے خارج کر دیا جاتا ہے. مثال کے طور پر، اگر پانی میں ردعمل کیو اور پی بی این او 3 خالص آئنک رد عمل ہو گا؛
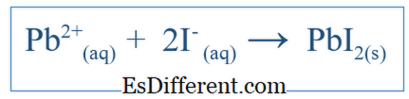
اس میں K + آئن اور NO3 - آئن کو بھی شامل ہونا چاہئے، لیکن ان کے آئنوں کو صرف تحلیل اور بڑے ردعمل میں حصہ نہیں لینا چاہیے؛ اس طرح، وہ نیٹ آئنک ردعمل میں شامل نہیں ہیں.
متوازن توازن اور نیٹ ایون مساوات کے درمیان کیا فرق ہے؟
- مت ماضی آرٹیکل مڈل ٹیبل سے پہلے>>
متوازن انضمام بمقابلہ نی نیٹ ایونیکی مساوات |
|
| استعمال کیا جاتا تمام اجزاء متوازن مساوات میں رینٹل کے طور پر لکھا جاتا ہے. | جو صرف خالص ردعمل میں ملوث تھے وہ اصلاح کاروں کو نیٹ آئنک ردعمل میں لکھا جائے گا. |
| مصنوعات | |
| ردعمل کے اختتام پر تمام اجزاء متوازن مساوات میں شامل ہیں. | خالص آئنک مساوات میں صرف نیٹ ورک کی مصنوعات صرف لکھی جاتی ہے. |
| تفصیلات دیئے گئے ہیں | |
| متوازن مساوات تمام پرجاتیوں کے بارے میں تفصیلات دیں گے جو نظام میں ہیں. | خالص آئنک مساوات صرف اس قسم کے پرجاتیوں کے بارے میں تفصیلات فراہم کرتا ہے جو ردعمل میں حصہ لیتا ہے |
خلاصہ - بیلنس ایونشن بمقابلہ نی نیٹ ایونیکی مساوات
جب کچھ مخصوص آئنک مرکبات پانی میں شامل ہوتے ہیں تو وہ الگ ہوجاتے ہیں پانی میں یہ ایکشن اور سنجیدگی پیدا کرتا ہے. ردعمل کی رد عمل اور سمت کی تکمیل کے بعد پیدا شدہ پرجاتیوں کو دکھانے کے لئے، کیمیائی مساوات لکھا جا سکتا ہے. یہ مساوات ہر ایک پرجاتیوں کی جوہری تعداد کی نظر پر غور کر سکتی ہے جو تیر کے دونوں اطراف پر رہتی ہے. کبھی کبھی، ان پرجاتیوں کا بھی چارج تصور کیا جانا چاہئے. یہ اس مخصوص نظام کے لئے متوازن کیمیائی مساوات دیتا ہے. تاہم، خالص آئنک مساوات صرف ردعمل پرجاتیوں میں شامل ہیں. جیسا کہ پہلے اشارہ کیا گیا ہے، متوازن مساوات اور خالص آئنک مساوات کے درمیان اہم فرق یہ ہے کہ متوازن مساوات ایک نظام میں تمام ردعمل ظاہر کرتا ہے جبکہ خالص آئنک مساوات صرف خالص ردعمل ظاہر کرتی ہے جو مخصوص ردعمل کی تکمیل میں ہوتی ہے.
حوالہ جات:
1. چانگ، آر، 2010. کیمسٹری. 10th ایڈ. نیویارک: میک گرا ہل.
2. کیمیائی ردعمل (این ڈی). مئی 26، 2017 کو // www سے حاصل ہوا. ric edu / faculty / ptiskus / reactions /
3. مکمل آئنک اور نیٹ آئنک مساوات. (این ڈی). مئی 26، 2017 کو // www سے حاصل کیا گیا. خانہ خانہ. این جی / سائنس / کیمسٹری / کیمیائی ردعمل - سٹوچیوموم / قسم کے کیمیائی ردعمل / ایک / مکمل-آئنیک اور نیٹ-آئنک مساوات.




