امونیم نائٹریٹ اور یورپ کے درمیان فرق
امونیم نائٹریٹ بمقابلہ یوے
کے لئے انتہائی ضروری عناصر میں سے ایک ہے نائٹروجن پر مشتمل مرکب عام طور پر کھاد کے طور پر استعمال کیا جاتا ہے کیونکہ نائٹروجن انتہائی لازمی عناصر میں سے ایک ہے پلانٹ کی ترقی اور ترقی. امونیم نائٹریٹ اور یوریا اس طرح کے نائٹروجن ہیں جو ٹھوس مشتمل ہیں.
امونیم نائٹریٹ
امونیم نائٹریٹ میں NH = 4 NO 3 کیمیائی فارمولا ہے. یہ امونیا کی نائٹریٹ ہے، اور یہ مندرجہ ذیل ساختہ ہے.
کمرے کے درجہ حرارت اور معیاری دباؤ امونیم نائٹریٹ پر بیزور، سفید کرسٹل ٹھوس کے طور پر موجود ہے. یہ تقریبا 5 پی ایچ پی کے ساتھ ایک امیڈک نمک ہے. 4. اس کا ملالہ بڑے پیمانے پر 80. 052 جی / mol ہے. امونیم نائٹریٹ کے پگھلنے کے نقطہ نظر تقریبا 170 ° C ہے اور یہ تقریبا 210
o سی کے بارے میں گرمی کی خرابی کرتا ہے. امونیم نائٹریٹ بنیادی طور پر زرعی مقاصد کے لئے استعمال کیا جاتا ہے. یہ نائٹروجن میں امیر ہے، لہذا یہ ایک کھاد کے طور پر استعمال کیا جاتا ہے، پودوں میں نائٹروجن کی فراہمی کے لئے. چونکہ کیمیکل کے ساتھ براہ راست رابطے خطرناک نہیں ہے اور اس کی زہریلا کم ہے، یہ ایک کھاد کے طور پر استعمال کرنے کے لئے فائدہ مند ہے. اس کے علاوہ، حرارتی یا انفیکشن کی وجہ سے امونیم نائٹریٹ پھٹنے کے سبب بنتا ہے. لہذا یہ دھماکہ خیز مواد میں ایک آکسائڈ ایجنٹ کے طور پر استعمال کیا جاتا ہے. اس دھماکہ خیز نوعیت کی نوعیت کی وجہ سے، امونیم نائٹریٹ کو ذخیرہ کرتے ہوئے ہمیں محتاط ہونا چاہئے. امونیم نائٹریٹ مستحکم ہے، لیکن جب یہ دھماکے کے لئے پھنسے ہوئے ریاستی خطرے میں ہے تو زیادہ ہے. خطرے میں اضافہ ہوتا ہے اگر یہ آکسائڈائز مواد جیسے تیل، ڈیزل، کاغذ، رگ، یا بھوک سے رابطہ کریں. امونیم نائٹریٹ کی پیداوار ایک عام کیمیائی رد عمل ہے. جب امونیا مائع کے ساتھ نائٹرک ایسڈ کا رد عمل کیا جاتا ہے، حل فارم میں امونیم نائٹریٹ پیدا ہوتا ہے. صنعتی طور پر، متعدد نائٹرک ایسڈ اور امونیا گیس پیداوار کے لئے استعمال کیا جاتا ہے. چونکہ یہ انتہائی غیر جانبدار اور پر تشدد ردعمل ہے، یہ بڑے پیمانے پر اس کی پیداوار کرنے میں مشکل ہے. نمک ہونے کے باوجود، امونیم نائٹریٹ پانی میں انتہائی گھلنشیل ہے. لہذا، جب یہ ایک کھاد کے طور پر استعمال کیا جاتا ہے جب دھویا جا سکتا ہے اور پانی کے اداروں میں جمع ہوسکتا ہے. یہ جامد زندگی کے لئے مہلک حالت ہوسکتی ہے.
یوریا میں CO (NH
2 ) 2 اور مندرجہ ذیل ساختہ کی آلودگی فارمولا ہے. یہ کاریگری گروپ سی = او کے ساتھ کاربائڈ ہے. دو این ایچ
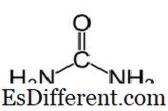
2 گروپوں کو دو طرفوں سے کاربوونی لبنان میں بند کر دیا جاتا ہے. یوریا قدرتی طور پر نائٹرروجن میٹابولزم میں چھاتیوں میں پیدا ہوتا ہے. یہ یوریا سائیکل کے طور پر جانا جاتا ہے، اور امونیا یا امینو ایسڈ کے آکسائڈریشن ہمارے جسم کے اندر یوریا پیدا کرتی ہے. یوریا میں سے زیادہ تر گردوں کے ذریعہ گردے کے ذریعہ کھایا جاتا ہے جبکہ کچھ پسینے کے ساتھ کھا جاتا ہے. یوریا کے اعلی پانی کی سوراخ کرنے والی اس سے فائدہ اٹھانے میں مدد ملتی ہے. یوریا ایک رنگارنگ، گندم ٹھوس ہے، اور یہ غیر زہریلا ہے. میٹابولک مصنوعات ہونے کے علاوہ، اس کا بنیادی استعمال کھاد پیدا کرنا ہے.یوریا سب سے زیادہ عام نائٹروجن جاری کھاد میں سے ایک ہے، اور اس میں دیگر ٹھوس نائٹریروجنس کھاد کے مقابلے میں اعلی نائٹروجن مواد ہے. مٹی میں، یوریا امونیا اور کاربن ڈائی آکسائیڈ میں تبدیل کیا جاتا ہے. یہ امونیا مٹی بیکٹیریا کی طرف سے نائٹائٹ میں تبدیل کیا جا سکتا ہے. اس کے علاوہ، یوریا استعمال کیا جاتا ہے دھماکہ خیز مواد جیسے یوورو نائٹریٹ پیدا کرنے کے لئے. یہ کیمیکلز جیسے پلاسٹک اور چپکنے والی پیدا کرنے کے لئے ایک خام مال کے طور پر استعمال کیا جاتا ہے.


