ایسڈ بیس بیس تناظر اور Redox ٹائٹریشن کے درمیان فرق | ایسڈڈ بیس ٹائٹریشن بمقابلہ Redox Titration
کلیدی فرق - ایسڈڈ بیس تائیوان بمقابلہ Redox طے شدہ
عام طور پر، اختتامی نقطۂ نظر کے عنوان کے عنوان کے تعین عام طور پر، ایک نامعلوم حل (تجزیہ) کی حراستی کا تعین کرنے کے لئے عنوانات استعمال کیے جاتے ہیں. سب سے زیادہ عام طور پر استعمال ہونے والے دو ٹریمیریٹک طریقوں میں ایسڈ بیس ٹائٹس اور ریڈ ٹاک عنوانات ہیں. عنوانات میں titrant اور تجزیہ کے درمیان ہوتا ہے جس میں ردعمل کی نوعیت کلیدی فرق ایسڈ بیس بیسٹریشن اور redox عنوانات کے درمیان
. ایسڈ بیس بیس عنوانات میں، ایک غیر جانبدار ردعمل ہوتا ہے اور redox عنوانات میں، ایک redox ردعمل ہوتا ہے (ایک آکسائڈائزیشن ردعمل اور کمی رد عمل). اشارے کا استعمال ردعمل کے اختتام پوائنٹ کا تعین کرنے کا سب سے عام استعمال کا طریقہ ہے.ایسڈڈ بیس ٹائٹلریشن کیا ہے؟ ایسڈ بیس بیس عنوانات میں، ایک ایسڈ (ایسڈیکی عنوانات) یا بیس (بنیادی عنوانات) titrant کے طور پر استعمال کیا جاتا ہے. امیڈ عنوانات میں استعمال کردہ ایسڈ کی مثالیں H 2 SO 4 ، HCl، یا HNO 3 ہیں. زیادہ تر استعمال شدہ بنیادی ٹائٹریٹز NaOH، K 2 CO 3 یا ن 2 CO 3 ہیں.
ایسڈ بیس بیس عنوانات ایسڈ اور بیس کی طاقت پر منحصر ہے مندرجہ ذیل درجہ بندی کی جا سکتی ہے.- - 9 ->
- مضبوط ایسڈ - مضبوط بنیاد عنوانات
- مضبوط ایسڈ- ضعیف بیس عنوانات
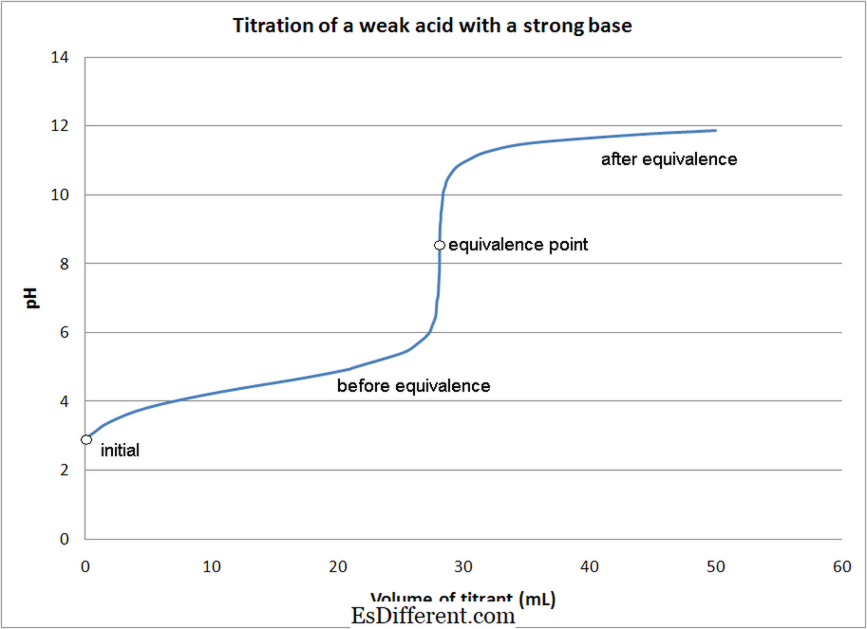
- کمزور ایسڈ - مضبوط بنیاد عنوانات
کمزور بنیاد پر کمزور بنیاد عنوانات
Redox طے شدہ کیا ہے؟

ایک ریڈ آکس ٹائٹریشن میں ایک ریڈکس ردعمل شامل ہے. Redox رد عمل دو ردعمل ہے؛ ایک آکسیکرن ردعمل اور کمی ردعمل. ایک ہی وقت میں آکسائڈریشن اور کمی کے عمل دونوں ہوتے ہیں جہاں ہم ردعمل کی تکمیل کا تعین کرنے کی اجازت دیتے ہیں. یہ عنوان کے اختتام نقطہ کے طور پر بھی جانا جاتا ہے. یہ کئی طریقوں سے طے کیا جا سکتا ہے؛ اشارے الیکٹروڈ کا استعمال کرتے ہوئے، redox اشارے (اشارے آکسیکرن کمی کمی ریاست میں ایک مختلف رنگ پیدا کرتا ہے)، اور غیر redox اشارے (اشارے ایک رنگ پیدا کرتا ہے جب اضافی رقم کی اضافی رقم شامل کی جاتی ہے).
ایسڈڈ بیس ٹائٹلریشن اور Redox Titration کے درمیان کیا فرق ہے؟
ردعمل کی نوعیت: ایسڈڈ بیس ٹائٹلریشن:
ایک ایسڈ بیس کی بنیاد پر تجزیہ (نامعلوم حراستی کے ساتھ حل) اور امیڈک یا بنیادی حوالہ جات کے درمیان غیر جانبدار ردعمل شامل ہے. Redox Titration:
ایک redox رد عمل میں تجزیہ اور titrant کے درمیان ایک آکسیکرن اور کمی ردعمل شامل ہے. اس طرح کا کوئی ایسا قاعدہ نہیں ہے جو اجزاء آکسائڈائز کرتی ہے اور جس میں کم ہوتا ہے. کسی بھی تجزیہ یا ٹائٹلنٹ آکسائڈیزس، اور باقی جزو اس کے مطابق کم کر دیتا ہے.
اختتام پوائنٹ کا تعین: ایسڈڈ بیس ٹائٹلریشن:
عام طور پر، ایک پی ایچ ایم اشارے، ایسڈ بیس ٹائٹریشن کے اختتام نقطہ کا تعین کرنے کے لئے ایک پی ایچ میٹر یا کنکشنانس میٹر استعمال کیا جاتا ہے. Redox ٹائٹریشن:
redox ردعمل کے اختتام نقطہ کا تعین کرنے کا سب سے زیادہ استعمال شدہ طریقوں کو ایک آلوٹومیٹر یا ایک ریڈ ایکس اشارے کا استعمال کر رہا ہے. لیکن، اکثر یا تو تجزیہ یا عنوانات اختتام پر ایک رنگ پیدا کرتا ہے. لہذا، ان معاملات میں اضافی اشارے کی ضرورت نہیں ہے.
مثال:
ایسڈ بیس بیس طے شدہ:| - مت ماضی آرٹیکل مڈل ٹیبل -> | قسم |
| ردعمل (اشارے) | مضبوط ایسڈ - مضبوط بیس ٹائٹل HCl + NaOHàNaCl + H 2 |
| O (Phenolphthalein / Methyl سنتری) | مضبوط ایسڈ - کمزور بیس ٹائٹلریشن ایچ سی ایل + این ایچ 3 à این ایچ 3 کل (مییتیل سنتری) کمزور بیس ٹائزیشن < CH |
| 3 | COOH + NaOHA CH 3 COONA + H 2 O (Phenolphthalein) کمزور ایسڈ - بنیاد بیس ٹائٹل CH |
| 3 | COOH + NH 3 àCH 3 COO - + NH 4 + (کوئی مناسب اشارے) Redox Titration: 2 KMnO |
4
+ 5 H 2 C 2 O 4 + 6 HCl → 2 MNN 2 + 2KCl + 10 CO 2 + 8 H 2 O (+ 7) (+3) (+2) (+ 4) مندرجہ بالا رد عمل میں، permanganate کم کیا جاتا ہے جبکہ آکسیلیک ایسڈ آکسائڈائزڈ ہے. جب ردعمل مکمل ہوجاتا ہے تو، permanganate کے جامنی رنگ رنگارنگ میں تبدیل ہوتا ہے. KMNO
4
+ 5FeCl
2 + 8HCl → 5FeCl 3 + MNCl 2 + KCl + 4H 2 اے (+ 7) (+2) (+3) (+2) تصویری عدالت: 1. مضبوط بیس کے ساتھ کمزور ایسڈ کی تزئین کی قسمومکنیٹکس (خود کا کام) [CC BY 3. 0]، Wikimedia Commons کے ذریعہ
2 کے ذریعہ. وائڈروڈ (CC BY-SA 3. 0] کی طرف سے کالم "




